公司新闻
2022 AACR Special Conference|青煜医药在2022年美国癌症研究协会癌症表观遗传学特别会议上公布 EED小分子抑制剂最新研究进展
2022年10月7日,青煜医药在2022年美国癌症研究协会癌症表观遗传学特别会议(AACR Special Conference: Cancer Epigenomics 2022)上,以壁报形式公布了EED小分子抑制剂在SWI/SNF功能缺失及高度依赖血管生成的实体瘤中机制机理的最新研究进展。此研究为公司自主研发的高效、高选择性的口服EED抑制剂针对实体瘤的适应症扩展提供了方向。
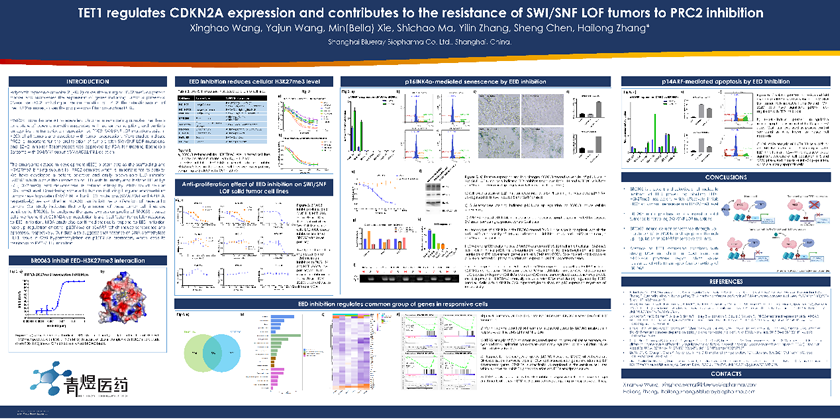
Polycomb repressive complex 2 (PRC2) 复合物催化H3K27me3表观遗传标记的形成并抑制包括肿瘤抑制因子在内的基因表达。过度活化的PCR2复合物,包括其催化亚基EZH2的激活突变,会促进DLBCL等肿瘤的进展。SWI/SNF 复合体是 ATP 依赖性染色质重塑复合物,可打开染色质且激活相关基因的转录,并部分拮抗 PRC2 的转录抑制作用。SWI/SNF 失活突变存在于~20%的肿瘤中,并与肿瘤进展有关。研究表明,PRC2对SWI/SNF 失活突变肿瘤的增殖很重要,EZH2抑制剂Tazemetostat被FDA批准用于治疗SWI/SNF亚基SMARCB1/INI1缺失的上皮样肉瘤。
EED蛋白作为PRC2复合物的重要组成蛋白及H3K27me3结合亚基,对其活性至关重要。使用青煜科学家研发的EED抑制剂BR1763,我们研究了可以预测EED抑制剂是否可以作用于SWI / SNF 失活的实体瘤细胞的生物标志物。通过分析BR1763处理细胞的基因表达谱,我们发现CDKN2A/p16INK4a上调是细胞对EED抑制剂敏感的关键因素。机制机理研究还证实, EED抑制剂的确在敏感细胞株中上调了p16INK4a,并通过抑制Rb的磷酸化诱导细胞衰老。 我们的数据还表明,DNA去甲基化酶TET1的缺失可能导致p16INK4a启动子上的CpG高甲基化,从而导致对PRC2 / EED抑制的抵抗。上述研究阐明了使用EED抑制剂治疗实体瘤的可能方向,其结果以海报形式发表在AACR 2022上。
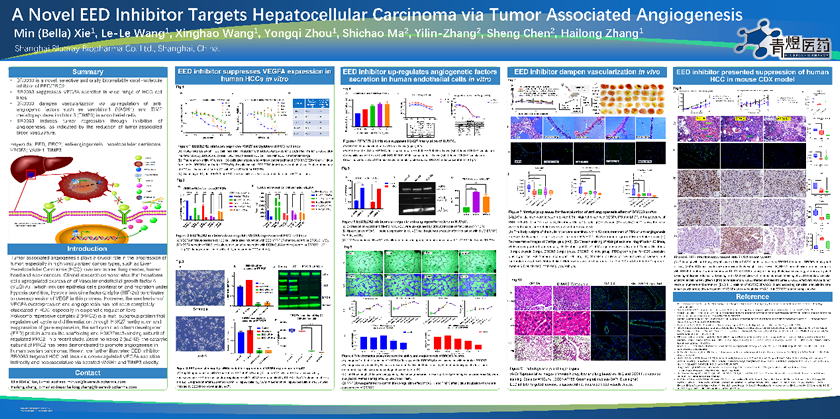
肿瘤相关的血管生成在高度依赖血管的肿瘤进展中起着至关重要的作用,如肝细胞癌,卵巢癌,肺癌,头颈癌等。临床研究表明,肝癌细胞上调血管内皮生长因子A(VEGFA)的表达,从而诱导上皮细胞增殖和迁移。然而,在表观遗传层面,肝癌中VEGFA过表达和血管生成的机制尚未完全阐明。
在文献中,PRC2的催化亚基EZH2已被证明可以促进人卵巢癌中的血管生成。青煜的科学家们进一步阐明了EED抑制剂BR1763在HCC细胞系或异种移植模型中的作用机理。BR1763通过上调抗血管生成因子如VASH1和TIMP3从而在体外和体内模型中表现出来对血管形成的明显抑制作用。同时,BR1763还下调了多种HCC细胞系中的VEGFA分泌,并且在不直接杀伤细胞的情况下在HCC异种移植模型中表现出了良好的疗效。此研究为高度依赖血管生成的实体瘤患者提供了一个可供选择的治疗方法。