公司新闻
2023AACR|青煜医药在2023年美国癌症研究协会公布两项最新研究成果
2023年4月,青煜医药在美国癌症研究协会(AACR)年会上,以壁报形式公布了EED小分子抑制剂BR1733的最新研究进展和基于肿瘤特异性表达的E3 ligase开发靶向蛋白降解PROTAC分子的最新研究进展,BR1733是公司自主研发的高效、高选择性的口服EED抑制剂,目前处于一期临床试验中。
EED抑制剂BR1733的最新研究成果
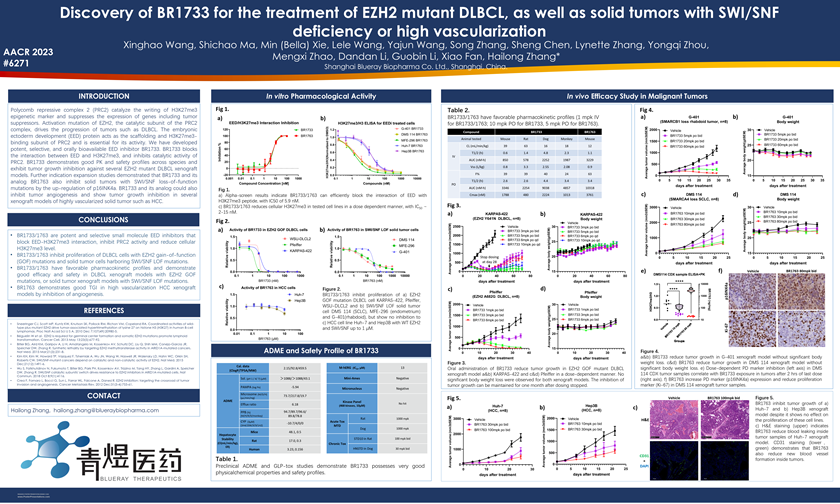
EED是多梳蛋白抑制复合物2(Polycomb repressive complex 2,PRC2)的重要组成蛋白。PRC2催化组蛋白H3K27me3的甲基化修饰并抑制包括肿瘤抑制因子在内的基因表达,其异常激活在一些肿瘤(如DLBCL)的生长中起到至关重要的作用。EED蛋白作为H3K27me3修饰的结合亚基,对PRC2的催化活性至关重要。
BR1733能够有效阻断EED与H3K27me3的相互作用,从而抑制PRC2的催化活性。BR1733在不同物种中均表现出良好的药代动力学特性和安全性,并在多种EZH2激活突变的DLBCL异种移植模型表现出明显的肿瘤生长抑制作用。我们的深入研究表明,BR1733及其类似物可以:
●上调p16INK4a,抑制具有SWI/SNF功能缺失突变的实体瘤的生长。
● 抑制肿瘤内新血管的生成,并在HCC等高度依赖血管的实体瘤异种移植模型中表现出明确的肿瘤生长抑制作用。
这些研究结果将为具有SWI/SNF功能缺失突变以及高度依赖血管生成的实体瘤患者提供一个可供选择的治疗方法。
基于肿瘤特异性E3 ligase的PROTAC分子的研究成果

靶向蛋白质降解(targeted protein degradation)技术是一种新颖的肿瘤治疗方法。作为异双功能分子,PROTAC的一端连接E3连接酶的配体,另一端连接靶蛋白的配体,中间通过合适的linker相连。PROTAC分子在体内可以将靶蛋白募集至E3连接酶,通过泛素-蛋白酶体系统(UPS)诱导靶蛋白泛素化以及随后的降解,进而达到治疗疾病的作用。迄今报道的PROTAC分子大多利用CRBN和VHL等E3 连接酶,这些E3连接酶在肿瘤和正常组织中均普遍表达。当靶蛋白对正常组织功能也很重要时,容易引发了潜在的毒性问题。因此,利用肿瘤特异性E3连接酶开发PROTAC分子可以提供良好的选择性并降低潜在的毒性。
我们选取WD40家族蛋白Fbxw7的R465C热点突变作为肿瘤细胞特异性表达的E3 ligase开展药物研发。该热点突变在结直肠癌和子宫内膜癌患者中占比约1.92%和2.98%。首先,我们利用公司自主开发的技术验证了Fbxw7可以降解多种非底物蛋白,是具有广泛降解谱的E3 连接酶。接下来,我们表达和纯化得到了Fbxw7 R465C靶蛋白,开发并优化了适合高通量筛选的实验方法,并通过筛选得到高选择性的小分子化合物。该类化合物与Fbxw7 R465C的特异性结合在X射线晶体学中得到了进一步验证。药化团队对该类化合物进行了优化并合成了一系列PROTAC分子。与传统的PROTAC分子相比,基于该类化合物合成的PROTAC分子可以选择性地在携带Fbxw7 R465C热点突变的肿瘤细胞中诱导靶向蛋白质降解。这类PROTACs分子将为携带Fbxw7 R465C突变的癌症患者提供一种新的治疗方法。